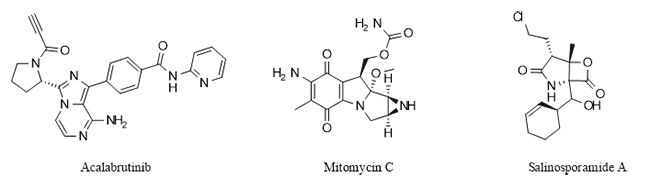
Abbildung 1 Stickstoffhaltige heterozyklische Arzneimittel
![Stickstoffhaltige heterozyklische Arzneimittel Stickstoffhaltige heterozyklische Arzneimittel]()
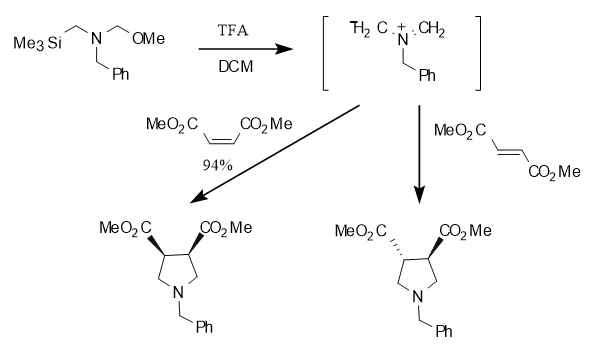
Es gibt viele Methoden zur Synthese stickstoffhaltiger heterozyklischer Verbindungen, darunter Cycloadditionsreaktionen, chemische Enzymsynthese, asymmetrische Katalyse, organische Elektrosynthese usw. Unter ihnen werden Cycloadditionsreaktionen häufig verwendet, um solche Verbindungen herzustellen. N-(Methoxymethyl)-N-(trimethylsilylmethyl)benzylamin ist ein 1,3-Dipol, der unter Einwirkung von Katalysatoren wie Trifluoressigsäure und TBAF in situ ein Methylenamin-artiges Ylid erzeugen und dann eine [3+2]-Cycloadditionsreaktion mit einem Dipolephil durchlaufen kann, um eine fünfgliedrige stickstoffheterozyklische Verbindung zu erhalten. Es ist erwähnenswert, dass die Reaktion eine vollständige cis-Stereoselektivität mit Kettenolefinen aufweist, was bedeutet, dass die ursprüngliche relative Stereokonfiguration des Moleküls während der Reaktion erhalten bleibt. Diese Eigenschaft ist von großer Bedeutung für die Synthese komplexer Moleküle mit spezifischen räumlichen Strukturen. Wie in Abbildung 2 unten gezeigt
![Cycloadditionsreaktion mit Kettenolefinen Cycloadditionsreaktion mit Kettenolefinen]()
Abbildung 2 Cycloadditionsreaktion mit Kettenolefinen
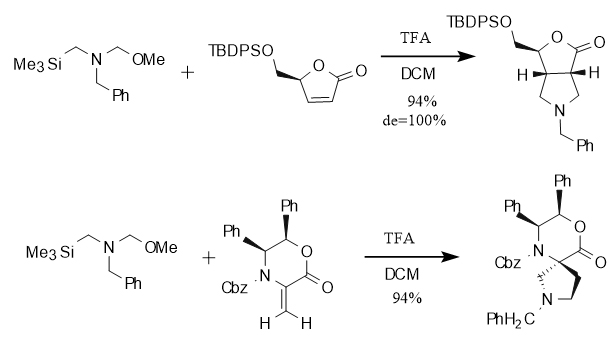
Darüber hinaus zeigt die [3+2]-Cycloadditionsreaktion mit N-(Methoxymethyl)-N-(Trimethylsilylmethyl)benzylamin eine ausgezeichnete Diastereoselektivität bei der Reaktion mit Olefinen, die zyklische Strukturen enthalten. Diese Eigenschaft ist entscheidend für den Aufbau von Molekülen mit komplexen räumlichen Konfigurationen. Insbesondere bei der Reaktion mit Cycloolefinen (Doppelbindungen im Ring) entstehen kondensierte Ringverbindungen, während bei der Reaktion mit Doppelbindungen außerhalb des Rings (die mit dem Ring verbunden sind) Spiroverbindungen entstehen. Diese Reaktionseigenschaft kann selektiv bestimmte Arten von zyklischen Strukturen aufbauen, wie in Abbildung 3 dargestellt.
Abbildung 3 Cycloadditionsreaktion mit cyclischen Olefinen
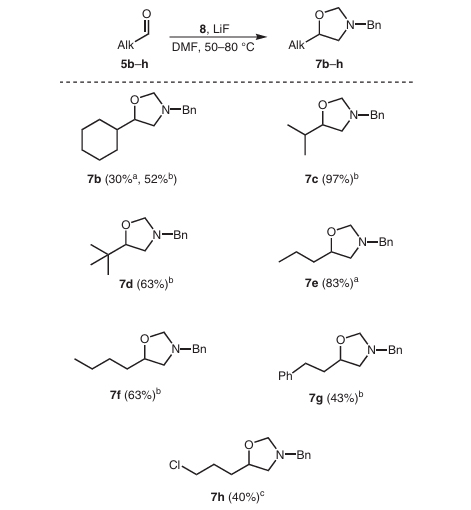
Erwähnenswert ist, dass das aus N-(Methoxymethyl)-N-(trimethylsilylmethyl)benzylamin gebildete Methylenamin-Ylid nicht nur mit Kohlenstoff-Kohlenstoff-Doppelbindungen unter Bildung von Ringen reagieren kann, sondern auch mit Carbonylgruppen. Es findet eine Cycloadditionsreaktion zur Herstellung von Oxazolidinverbindungen statt, wie in Abbildung 4 gezeigt: Unter der Katalyse von Lithiumfluorid reagiert N-(Methoxymethyl)-N-(trimethylsilylmethyl)benzylamin mit verschiedenen Arten von Fettaldehyden. Die Reaktion ergibt die entsprechenden Oxazolidinverbindungen in guten Ausbeuten.
Abbildung 4 Cycloadditionsreaktion mit aliphatischen Aldehyden
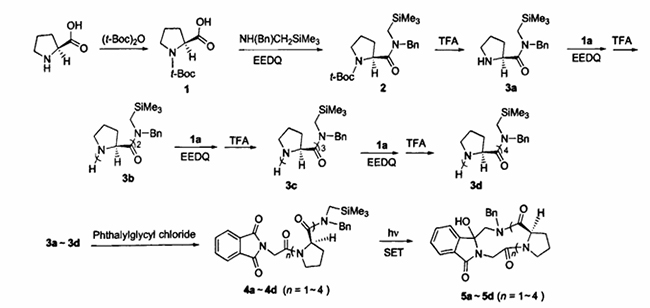
N-(Methoxymethyl)-N-(trimethylsilylmethyl)benzylamin ist ein häufig verwendetes Reagenz in Cycloadditionsreaktionen und wird häufig bei der Synthese von polysubstituierten Pyrrolidinverbindungen und pharmazeutischen Zwischenprodukten verwendet. Diese Verbindung wird üblicherweise durch die Reaktion von N-(Trimethylsilylmethyl)benzylamin mit Formaldehyd und Methanol gewonnen. Der Rohstoff N-(Trimethylsilylmethyl)benzylamin ist auch ein wichtiges Zwischenprodukt der organischen Synthese. Es kann mit Reagenzien wie Aldehyden reagieren, um heterozyklische Verbindungen durch Dreikomponentenreaktionen direkt aufzubauen. Es kann auch zur Synthese von stickstoffheterozyklischen Prolinpeptiden verwendet werden, wie in Abbildung 5 dargestellt:
Abbildung 5 Syntheseweg stickstoffhaltiger heterozyklischer Prolinpeptide
Referenzen
[1] Amin, A.; Qadir, T.; Abe, H.; et al. Ein Überblick über die medizinischen und industriellen Anwendungen von N-haltigen Heterocyclen [J]. The Open Medicinal Chemistry Journal, 2022, 16.
[2] Kumar, A.; Singh, AK; Kumar, P.; et al. Stickstoffhaltige Heterocyclen als Mittel gegen Krebs: Eine medizinische Chemie-Perspektive[J]. Pharmaceuticals, 2023, 16, 299.
[3] N-Benzyl-N-(methoxymethyl)-N-trimethylsilylmethylamin. Enzyklopädie der Reagenzien für die organische Synthese, 2001.
[4] Gorbunova, E.; Buev, EM; Moshkin, VS; et al. Drei Arten, wie aliphatische Aldehyde mit nicht stabilisierten Azomethinyliden reagieren[J]. SynLett, 2020, 31.
[5] Liu Yan, Tan Guanghui, Jin Yingxue et al. Synthese von N-heterozyklischen Prolinpeptiden durch photoinduzierte Einzelelektronentransferreaktion[J]. Organische Chemie, 2011, 31, 480-485.