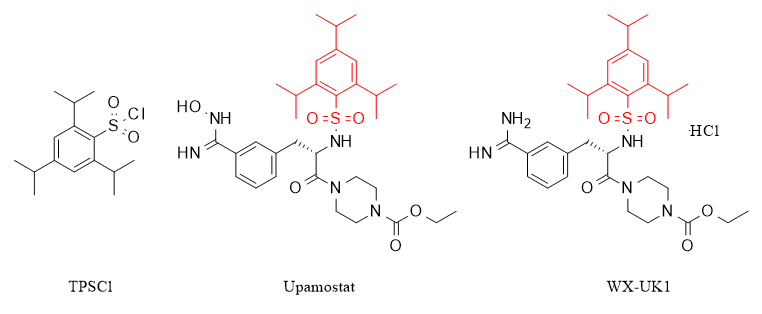
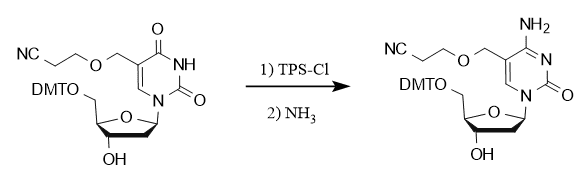2,4,6-Triisopropylbenzolsulfonylchlorid (kurz TPSCl), eine der wichtigsten Organoschwefelverbindungen in der organischen Synthese, wird in einer Vielzahl von synthetischen Anwendungen wie Pharmazeutika, Elastomeren, Farbstoffen, Reinigungsmitteln, Ionenaustauscherharzen und Herbiziden eingesetzt. Es ist hervorzuheben, dass TPSCl nicht nur selbst eine ausgezeichnete biologische Aktivität aufweist und ein potenter 3MDR-Proteininhibitor mit guter antidepressiver Aktivität ist, sondern dass TPSCl darüber hinaus auch die wichtigste Struktureinheit einiger Proteaseinhibitoren ist, wie in der Abbildung gezeigt. TPSCl stellt einen Proteaseinhibitor dar, der eine einzigartige Struktur mit potenziellem funktionellem Wert aufweist.
![TPSCl TPSCl]()
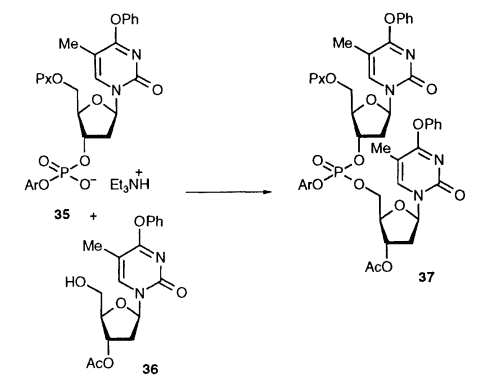
TPSCl wird häufig im Bereich der organischen Synthese verwendet. Es ist ein hochselektives Kondensationsmittel, das ursprünglich von Khoranas Team vorgeschlagen und in der Oligo- und Polynukleotidsynthese eingesetzt wurde, um die Bindung zwischen C3′-C5′-Nukleotiden herzustellen. Wie in der folgenden Abbildung gezeigt, unterliegen unter der Einwirkung von TPSCl die 3′-Phosphatgruppe der ersten Nukleotideinheit und die 3′-Phosphatgruppe der zweiten Nukleotideinheit effizient einer Kondensationsreaktion. Eine stabile Phosphatbindung wird ohne die Notwendigkeit von Zusatzstoffen gebildet.
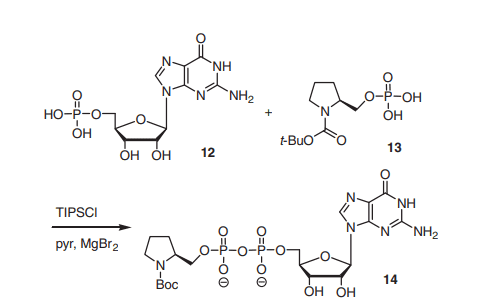
Darüber hinaus kann TPSCl auch zur Synthese von Diphosphaten verwendet werden, z. B. von Guanosin-Pyrrolidin-Diphosphat-Derivaten, die als potenzielle Fucosyltransferase-Inhibitoren vorgeschlagen wurden.
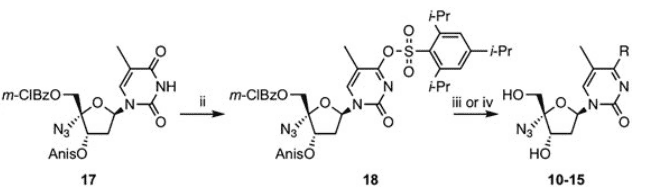
TPSCl spielt auch eine wichtige Rolle bei der Carbonyl-Aminierungsreaktion an der C-4-Position von Nukleosidbasen, wie die Synthese von 5-Hydroxymethyl-2′-desoxycytidin-Phosphoramidit-Analoga zeigt, bei der die Umwandlung von Uridin in Cytidin unter Beteiligung von TPSCl erreicht wurde.
Ein weiteres Beispiel ist die Synthese eines Wirkstoffs gegen das Hepatitis B-Virus durch Imotos Team, das ebenfalls die Umwandlung von Carbonyl in Amino mit Hilfe von TPSCl realisierte.
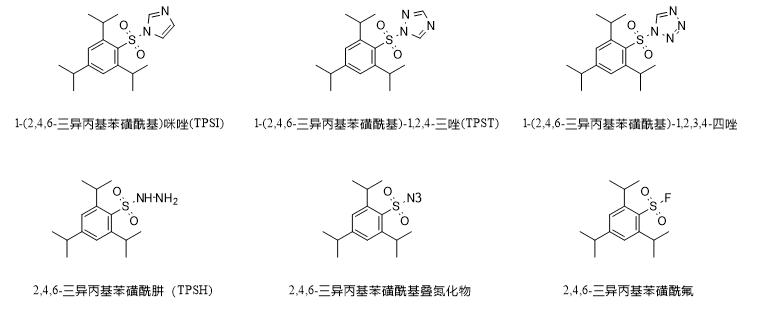
Neben den oben genannten Anwendungen ist TPSCl auch der wichtigste Rohstoff für die Synthese anderer multifunktionaler Reagenzien, wie in der folgenden Abbildung gezeigt, einschließlich TPSI, TPST, 1-(2,4,6-Triisopropylbenzolsulfonyl)-1,2,3,4-Tetrazol usw., die für die Kondensation von Nukleotiden verwendet werden; TSFH, das für die Reduktion von Olefinen und die Synthese von Hydrazon verwendet wird; und 2,4,6-Triisopropylbenzolsulfonylazid, das für die Übertragung von Diazid und Azid verwendet wird. Isopropylbenzolsulfonylazid für die Diazotierung und Azidübertragung.
![TPSCl TPSCl]()
Referenz:
[1] Jeelani, A.; Muthu, S.; Irfan, A.; et al. Experimentelle spektroskopische, molekulare Struktur, elektronische Solvatation, biologische Vorhersage und topologische Analyse von 2, 4, 6-Tri (propan-2-yl) benzolsulfonylchlorid: Ein Antidepressivum[J]. J. Mol. Liq. 2022, 358, 119166.
[2] Renatus, M.; Bode, W.; Huber, R.; et al. Strukturelle und funktionelle Analysen von Benzamidin-basierten Inhibitoren im Komplex mit Trypsin: Auswirkungen auf die Hemmung von Faktor Xa, tPA und Urokinase[J] J. Med. Chem. 1998, 41, 5445-5456.
[3] Colin, BR; Zhang, PZ Phosphotriester-Ansatz zur Synthese von Oligonukleotiden: Eine Neubewertung[J]. J. Chem. Soc., Perkin Trans. 1, 1993, 2291-2301.
[4] Lin, TC; Fang, JM Diphosphatbildung unter Verwendung von Cyanurchlorid oder Triisopropylbenzolsulfonylchlorid als Aktivierungsmittel[J]. Tetrahedron Letters. 2011, 52, 2232-2234.
[5] Zheng Xiu-An. Forschung zu Synthesemethoden für spezielle Nukleoside und Nukleosidphosphorylverbindungen [D]. Jiangxi: Jiangxi Normal University of Science and Technology, 2019.
[6] Onitsuka, K.; Tokuda, R.; Lmoto, S.; et al. Synthese und Bewertung der Anti-Hepatitis-B-Virus-Aktivität von 4'-Azido-Thymidin-Analoga und 4'-Azido-2'-desoxy-5-methylcytidin-Analoga: Strukturelle Erkenntnisse für die Entwicklung eines neuen Anti-HBV-Wirkstoffs[J]. NUCLEOS NUCLEOT NUCL. 2020, 39, 518-529.
[7] Narang, SA; Itakura, K.; Katagiri, N. Neue Kondensationsreagenzien für die Polynukleotidsynthese[J]. JCS CHEM. COMM. 1974, 325-326.