Etwa ein Drittel der 200 weltweit meistverkauften Medikamente im Jahr 2019 enthalten Amidbindungen [2,3]. Die Entwicklung effizienter Amidsynthesemethoden ist seit langem eines der Hauptziele der synthetischen Chemie. Die grüne und umweltfreundliche Amidsynthesemethode wurde vom Green Chemistry Institute der American Chemical Society als zentraler Forschungsbereich identifiziert und wird kontinuierlich weiterentwickelt [4].
Gleichzeitig ist die Bildung von Amidbindungen eine der grundlegendsten und wichtigsten Reaktionen auf dem Gebiet der Peptid- und Proteinsynthese. Nach langfristiger Forschung haben Wissenschaftler viele Methoden zum Aufbau von Amidbindungen entwickelt, wie z. B. gemischte Anhydride, Acylazidmethoden, Kondensationsmittelmethoden und andere Methoden, aber die am weitesten verbreitete ist immer noch die kondensationsmittelvermittelte Amidsynthesemethode. Herkömmliche Kondensationsmittel weisen immer noch einige Mängel in Bezug auf Reaktionseffizienz, optische Reinheit, sterische Hinderung, Stabilität, Trennung usw. auf. Darüber hinaus hat die geringe Atomökonomie der Festphasenpeptidsynthese große Herausforderungen für die nachhaltige Entwicklung mit sich gebracht. Daher ist die Entwicklung eines effizienten, einfachen und optisch reinen Kondensationsreagenz ein großes Problem, das Forscher plagt.
In den letzten Jahren hat sich das Team von Professor Zhao Junfeng der Lösung der schwierigen Probleme auf dem Gebiet der chemischen Synthese von Peptiden und Proteinen verschrieben, indem es neue Reagenzien und neue Reaktionen rund um die Bildung von Amidbindungen entwickelt hat. Durch unermüdliche Anstrengungen entwickelten sie ein neues strukturelles Alkinamid-Kondensationsreagenz, Ynamide, das eine effiziente und racemisierungsfreie Konstruktion von Amidbindungen ermöglicht[5].
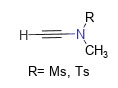
Repräsentative Produkte dieser Art von Reagenz sind N-Methylethinylmethansulfonamid (MYMsA) und N-Methylethinyl-p-toluolsulfonamid (MYTsA). Sie haben ein geringes Molekulargewicht, erfordern keine Zugabe zusätzlicher Katalysatoren, sind luft- und wasserbeständig und können das Zielamid unter nahezu neutralen Bedingungen nahezu quantitativ erhalten. Noch wichtiger ist, dass Carbonsäuren mit α-chiralen Zentren während des Kondensationsprozesses keine Racemisierung erfahren. Abbildung 1 zeigt die allgemeine Strukturformel von Acetylenamid-Reagenzien [6].
Abbildung 1
Die von Professor Zhaos Team entwickelten Alkinamid-Reagenzien finden breite Anwendung und können bei der Synthese gängiger Amide und Peptidfragmente, Ester und Makrolide, Thioamide usw. eingesetzt werden. Im Folgenden wird der Forschungsfortschritt dieser Art von Alkinamid-Kondensationsreagenzien in synthetischen Anwendungen detailliert vorgestellt.
1. Wird für die Amid- und Peptidsynthese verwendet
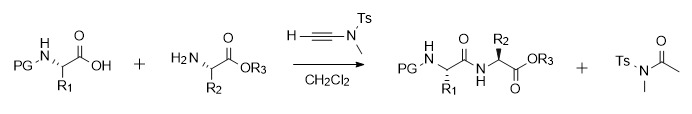
Die Alkinamid-vermittelte Amidbindungssynthese kann sowohl bei Carbonsäureaktivierungs- als auch bei Aminolysereaktionen spontan und effizient ablaufen. Daher hat die Forschungsgruppe von Professor Zhao eine zweistufige Eintopfmethode angewendet, d. h. das aktivierte Zwischenprodukt wurde nicht abgetrennt und die anschließende Reaktion mit Amin wurde direkt durchgeführt, was den Vorgang vereinfachte. Dieses Schema ist gut universell einsetzbar. Es ist auf Substrate mit großer sterischer Hinderung und chirale Aminosäuren anwendbar, ohne dass es zu Racemisierung kommt. Darüber hinaus eignet sich die Alkinamid-vermittelte Reaktion nicht nur für die Synthese von Amiden und Dipeptiden, sondern kann auch für die Synthese von Peptidfragmenten verwendet werden (wie etwa die Synthese von Leu-Enkephalin mit Schutzgruppen). Darüber hinaus ist diese Art von Kondensationsreagenz gut verträglich mit vielen funktionellen Gruppen und kann in Gegenwart von funktionellen Gruppen in den Seitenketten von Aminosäuren wie OH, SH, CONH2 und NH von Indol auftreten [6].
![hochfein hochfein]()
Abbildung 2 Amidsynthese
2. Wird zur Synthese von Estern (Thioestern) und Makroliden verwendet
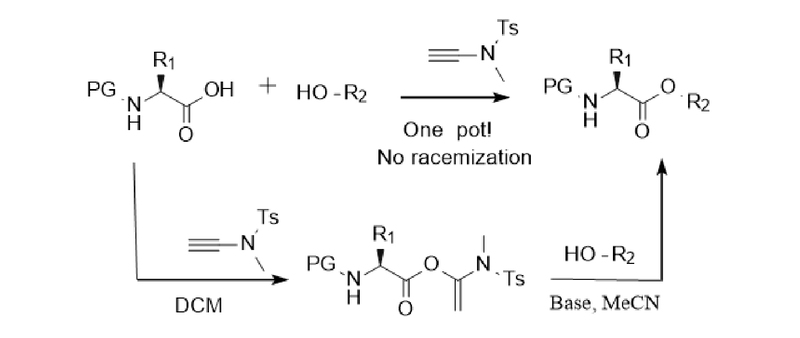
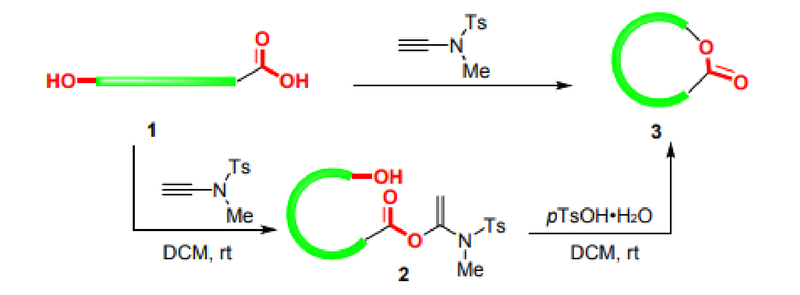
Esterbindungen sind wichtige funktionelle Gruppen in vielen Naturprodukten und Feinchemikalien. Thiocarbonylester sind auch wichtige Zwischenprodukte für die Umwandlung funktioneller Gruppen. Makrolide bilden das Grundgerüst vieler Arzneimittel und Naturprodukte. Da die durch die Reaktion von Alkinamidreagenzien mit Carbonsäuren erzeugten aktivierten Ester stabil sind und bis zu einem halben Jahr im Kühlschrank aufbewahrt werden können, hat die Forschungsgruppe von Professor Zhao die Anwendung von Alkinamidreagenzien weiter ausgebaut und Schemata für die intermolekulare Veresterung und Makrolidsynthese entwickelt, wie in Abbildung 3 dargestellt: Unter alkalischen Bedingungen kann Acetonitril als Lösungsmittel verwendet werden, um Veresterungsreaktionen reibungslos durchzuführen. Bei chiralen α-Aminosäuren kann die Racemisierung auch durch die Katalyse von DIEA vermieden werden. Die Substrate sind universell und können für (Thiol-)Alkohole und (Thio-)Phenole verwendet werden. Darüber hinaus gibt es bei der Synthese von Makroliden Probleme wie Racemisierung, cis-trans-Isomerisierung, intermolekulare Polymerisation und Ringschluss-Nebenreaktionen, die vielen Forschern schon immer Probleme bereitet haben. Die Forschungsgruppe von Professor Zhao synthetisierte Makrolide erfolgreich unter Verwendung von Alkinamid-Reagenzien (Abbildung 4). Unter der Katalyse von p-Toluolsulfonsäurehydrat wurde immer noch die zweistufige Eintopfmethode verwendet. Makrolide können auch bei hohen Konzentrationen bei Raumtemperatur erfolgreich synthetisiert werden, wodurch Probleme wie Racemisierung und cis-trans-Isomerisierung wirksam vermieden werden [7,8,9].
![hochfein hochfein]()
Abbildung 3 Intermolekulare Veresterung
Abbildung 4 Synthese von Makroliden
3. Thioamide und Thiopeptide
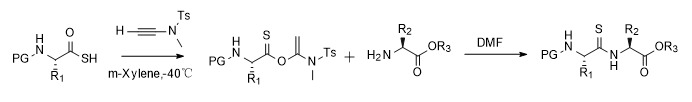
Die präzise Modifizierung und Funktionalisierung von Peptiden und Proteinen ist zu einem unverzichtbaren Werkzeug in der chemischen Biologie geworden. Thioamidbindungen können herkömmliche Peptidbindungen ersetzen, um verschiedene physikalische und chemische Eigenschaften zu erhalten, wie z. B. die Verbesserung der Widerstandsfähigkeit von Peptiden gegen enzymatischen Abbau und die Herstellung von Sonden mit einzigartigen spektralen Eigenschaften. Aufgrund der Einschränkungen der synthetischen Methoden ist auch die Anwendung von Thioamiden im Bereich der Proteinbiologie begrenzt. Als Antwort auf die Herausforderung, Thioamidbindungen in Proteine und Peptide einzuführen, entwickelte die Forschungsgruppe von Professor Zhao Junfeng ein Thioamidsyntheseschema, das durch Alkinamide vermittelt wird. In Dichlormethan oder DMF können Thioamide ohne Racemisierung erhalten werden. Bei der Festphasenpeptidsynthese können die durch Thiocarbonsäuren und Alkinamide hergestellten aktivierten Esterzwischenprodukte effizient in Zielprodukte (alle 19 natürlichen Aminosäuren außer Histidin) umgewandelt werden, wodurch der Grundstein für die Untersuchung von Thioamiden in der chemischen Biologie von Peptiden und Proteinen gelegt wird [10,11].
![hochfein hochfein]()
Abbildung 5 Synthese von Thioamid
Alkinamid-Kondensationsmittel haben nicht nur die Vorteile traditioneller Kondensationsreagenzien und aktivierter Ester, sondern gleichen auch deren Nachteile aus. Sie bieten neue Methoden für die Synthese wichtiger Substanzen wie Amide und Polypeptide, Ester und Makrolide sowie Thiopeptide und haben eine wichtige wissenschaftliche Bedeutung auf dem Gebiet der Polypeptid- und Proteinsynthese. Darüber hinaus konnte Suzhou Haofan durch die Bemühungen unserer wissenschaftlichen Forscher Alkinamid-Kondensationsreagenzien bereitstellen. Gleichzeitig engagiert sich unser Unternehmen für die Forschung und Entwicklung sowie die Produktion von Amid- und Polypeptidsynthesereagenzien. Nach 20 Jahren Entwicklung und Akkumulation ist unser Unternehmen zum weltweit größten und umfassendsten Anbieter von Amidsynthesereagenzien geworden. Die Kondensationsreagenzien der ersten bis vierten Generation sind alle im Angebot. Freunde mit Bedarf können uns gerne für Anfragen anrufen.
Referenzen:
[1] Boström, J.; Brown, DG; Young, RJ; et al. Erweiterung des synthetischen Werkzeugkastens der Medizinalchemie [J]. Nat. Rev. Drug. Discov. 2018, 17, 709-727.
[2] Top 200 Drugs 2019——Das Poster. https://www.pharmaexcipients.com/news/top-200-drugs-2019/ (abgerufen am 18.12.2021)
[3] Magano, J. Amidierungen im großen Maßstab in der Prozesschemie: Praktische Überlegungen zur Reagenzienauswahl und Reaktionsdurchführung[J]. Org. Process Res. Dev. 2022, 26, 1562-1689.
[4] Bryan, MC; Dunn, PJ; Entwistle, D.; et al. Wichtige Forschungsbereiche der Grünen Chemie aus der Sicht eines Pharmaherstellers erneut betrachtet[J]. Green Chem. 2018, 20, 5082− 5103.
[5] Liu, T.; Xu, SL; Zhao, JF Jüngste Fortschritte bei Inamid-Kupplungsreagenzien[J]. Chin. J. Org. Chem. 2021, 41, 873-887.
[6] Hu, L.; Xu, SL; Zhao, JF; et al. Inamide als racemisierungsfreie Kupplungsreagenzien für die Amid- und Peptidsynthese[J]. J. Am. Chem. Soc. 2016, 138, 13135-13138.
[7] Wang, XW; Yang, Y.; Zhao, JF; et al. Inamid-vermittelte intermolekulare Veresterung[J]. J. Org. Chem. 2020, 85, 6188-6194.
[8] Yao, CC; Yang, JH; Zhao, JF; et al. Inamid-vermittelte Thionoester- und Dithioestersynthesen[J]. Org. Lett. 2020, 22, 6628-6631.
[9] Yang, M.; Wang, XW; Zhao, JF Inamid-vermittelte Makrolactonisierung[J]. ACS Catal. 2020, 10, 5230-5235.
[10] Yang, JH; Wang, CL; Xu, SL; Zhao, JF Inamid-vermittelte Thiopeptidsynthese[J]. Angew. Chem. Int. Ed. 2018, 58, 1382-1386.
[11] Yang, JH; Wang, CC; Zhao, JF; et al. Ortsspezifische Eingliederung mehrerer Thioamidsubstitutionen in ein Peptidrückgrat mittels Festphasenpeptidsynthese[J]. J. Org. Chem. 2020, 85, 1484-1494.