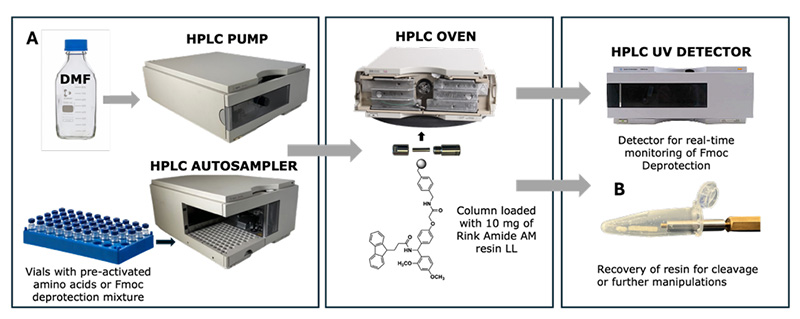
I. Hintergrund und Einleitung:
In den letzten Jahren haben mikrowellenunterstützte Synthese und Durchflusssynthese die Effizienz und Ausbeute der Festphasensynthese weiter verbessert. Diese Techniken erfordern jedoch typischerweise teure und hochspezialisierte Geräte, was ihre breite Anwendung in Routinelaboren einschränkt. Darüber hinaus weist HATU, das in der Fmoc-Festphasensynthese weit verbreitete Aktivierungsreagenz, eine geringe thermische Stabilität auf und birgt Sicherheitsrisiken.
Vor diesem Hintergrund nutzte das Team um Nicolas Winssinger an der Universität Genf, Schweiz, ein universelles Flüssigchromatographiesystem und modifizierte es für Durchflusschemie-Techniken, um so die Transformation eines Hochleistungsflüssigkeitschromatographen (HPLC) in einen Peptidsynthesizer zu erreichen.
II. Flüssigphasenverfahren:
HPLC ist eine gängige Trenn- und Analysetechnik. Proben werden mithilfe einer chromatographischen Säule in ihre Komponenten getrennt, um die Probenreinheit zu bestimmen. Dieses Team nutzte innovativ eine mit 10 mg Harz gefüllte Vorsäule als Mikroflussreaktor mit einer internen 2 μm Schmelze, um Harzverluste zu verhindern. Gleichzeitig lieferte ein DAD-Detektor (zur Detektion von Fmoc-Abspaltungsprodukten) Echtzeit-Feedback zu den Syntheseergebnissen.
Dieses Verfahren verwendet TBEC (1-tert-Butyl-3-ethylcarbodiimid)/Oxyma (Ethyl-2-oximcyanoacetat) als Aktivierungssystem. Dadurch entfällt die Notwendigkeit zusätzlicher Alkalizugabe und Voraktivierungsschritte, was den Prozess vereinfacht und ihn sicherer und umweltfreundlicher macht.
Basierend auf der beschriebenen Ausrüstung und dem Aktivierungssystem wurde Phenylalanin-Pentamer als Modellsubstanz verwendet, um Synthesebedingungen zu untersuchen und diese auf dem modifizierten HPLC-System zu optimieren. Die experimentellen Ergebnisse zeigten, dass unter den optimierten Bedingungen das Zielpentapeptid erfolgreich synthetisiert wurde, wobei eine Rohproduktreinheit von >93 % und eine Einstufenreinheit von >99 % erreicht wurden.
Die genaue Methode ist wie folgt:
| Instrumentenmodell |
Agilent 1260 Infinity |
| Automatische Abtastlautstärke |
100 μL |
Säulentemperatur |
80℃ |
| chromatographische Säule |
C18-Kieselgelsäule / Hypersil Gold C18-Chromatographiesäule |
Schutzsäule |
Harzgefüllt (20 x 2 mm) |
| Detektor |
DAD-Detektor |
Detektionswellenlänge |
360 nm |
| Durchflussrate |
1,0 ml/min |
mobile Phase |
Mobile Phase A: Aktivierte Esterlösung |
| Waschprozess |
Stunde/Minute |
0 |
0,1 |
1,5 |
2.0 |
| Mobile Phase A |
100 |
100 |
100 |
100 |
III. Betriebsabläufe:
Der gesamte Syntheseprozess umfasst die folgenden Schritte:
1. Harz einwiegen und befüllen: 10 mg Harz (z. B. Rink-Amid-Harz) abwiegen und in die leere Schutzsäule füllen. Anschließend verschließen und fixieren.
2. Harz quellen lassen: Die mit Harz beladene Schutzsäule in Dichlormethan tauchen und 3–5 Minuten quellen lassen.
3. Installation: Die Ofentemperatur auf 80 °C einstellen und die Schutzsäule in den entsprechenden Halter einsetzen. 4.
Reagenzlösung herstellen:
Probenlösung: 0,6 M Fmoc-Aminosäure, TBEC und Oxyma-NMP-Lösung herstellen und zu gleichen Teilen mischen, um eine 0,2 M Lösung zu erhalten.
Entschützungslösung: 20 % Piperidin in DMF geben und in ein Autosampler-Vial für die spätere Verwendung überführen.
5. Injektionssequenz programmieren: Das Gerät so einstellen, dass abwechselnd die Lösung des aktivierten Aminosäurederivats (zur Kupplung) und die 20%ige Piperidin-DMF-Lösung (zur Entschützung) injiziert werden. Zusätzlich sollte die Entschützung vor Beginn der Synthese zweimal hintereinander durchgeführt werden, um die vollständige Entfernung der ursprünglichen Fmoc-Schutzgruppe zu gewährleisten.
6. Harzlyse und Entschützung: Die Vorsäule wird in Dichlormethan getaucht, um restliches DMF zu entfernen. Anschließend wird das Harz entnommen und 3 Stunden lang in eine TFA-Lösung (TFA/Triisopropylsilan TIS/H₂O = 95:2,5:2,5) getaucht, um eine vollständige Dissoziation und Entschützung zu erreichen. Für spezifische Sequenzen mit Cystein, Methionin usw. kann ein gemischter Lysepuffer aus TFA/1,2-Ethylendithiol EDT/TIS/H₂O = 90:5:2,5:2,5 verwendet werden.
7. Produktaufbereitung: Das Harz wird abgetrennt, um das Rohpeptid für die weitere Reinigung auszufällen.
IV. Einflussfaktoren:
Bei racemischen Aminosäuren wie Histidin und einigen speziellen Aminosäuren hat die Voraktivierungszeit einen signifikanten Einfluss auf die Kupplungseffizienz. Im Rahmen der Synthese von 20 Peptiden verglich das Team die Kupplungseffizienz frisch hergestellter aktiver Ester mit derjenigen von 24 Stunden voraktivierten Estern. Dabei zeigte sich, dass Fmoc-Arg(pbf)-OH und Fmoc-His(Trt)-OH nach längerer Aktivierung eine relativ geringe Kupplungseffizienz aufwiesen.
Um den Einfluss der Voraktivierungszeit auf die Kupplungseffizienz weiter zu untersuchen, wurden FRF-Tripeptide mit Fmoc-Arg(pbf)-OH als Ausgangsmaterial und Voraktivierungszeiten von 15 Minuten bzw. 24 Stunden synthetisiert. Die Ergebnisse zeigten, dass die Kupplungseffizienz nach 24 Stunden Voraktivierung deutlich abnahm. Dies wird auf die intramolekulare Cyclisierung von Fmoc-Arg(pbf)-OH nach der Aktivierung zurückgeführt, wodurch dessen Reaktivität reduziert wird. Wiederholte Experimente bestätigten, dass die optimale Aktivierungslösung innerhalb von 4 Stunden nach ihrer Herstellung verwendet werden sollte.
V. Differentielle Isomerisierung:
Isomerisierung während der Peptidsynthese kann die stereochemische Reinheit beeinträchtigen und die biologische Aktivität verändern. Um den Grad der Racemisierung unter diesen Synthesebedingungen zu bestimmen, untersuchte das Team leicht racemisierbare Aminosäuren wie Prolin, Cystein und Serin mittels einer Flüssigphasensynthese. Dabei wurde bei keiner der Aminosäuren eine Racemisierung beobachtet. Zum Vergleich der Kopplungseffekte des TBEC/Oxyma-Systems und des HATU/DIPEA-Systems verwendete das Team frisch aktiviertes His(Trt) für die Reaktion. Die Experimente ergaben, dass das TBEC/Oxyma-System eine Epimerisierung von 3,6 % aufwies, während das HATU/DIPEA-System eine Isomerisierungsrate von 4,8 % zeigte.
VI. Praktische Anwendungen:
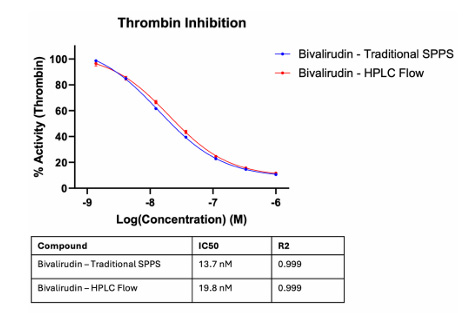
Dem Team gelang die erfolgreiche Synthese von Peptiden wie GLP-1 (30 Aminosäuren) und Bivalirudin (20 Aminosäuren). Die Ausbeute für GLP-1 betrug 52,1 % bei Verwendung einer Synthesesäule mit 10 mg Harz. Hinsichtlich der Bioaktivität zeigten das mittels HPLC synthetisierte Roh-Bivalirudin und das mittels konventioneller Festphasenpeptidsynthese (SPPS) hergestellte reine Bivalirudin eine vergleichbare Bioaktivität (siehe Abbildung unten).
Abbildung 5
VII. Vorteile und Einschränkungen:
Das leicht verfügbare HPLC-System, das für die automatisierte Flüssigsynthese von Peptiden eingesetzt wird, hat folgende Vor- und Nachteile:
1. Vorteile:
- Standard-HPLC in eine multifunktionale Syntheseplattform umwandeln;
- Verwenden Sie ein sichereres TBEC/Oxyma-Aktivierungssystem;
- Es ermöglicht die Gewinnung hochreiner Peptide und die Überwachung der Reaktion in Echtzeit;
- Es weist eine gute Stereoselektivität auf und kann Polypeptide mit komplexen Sequenzen synthetisieren;
- Es ist wirtschaftlich, nutzt weit verbreitete HPLC-Geräte, senkt die Gerätekosten und kann mehr Laboren zugutekommen;
- Es bietet hohe Flexibilität und kann zur Synthese von Peptiden/Oligonukleotiden eingesetzt werden. Durch den Austausch der Säule ermöglicht es außerdem den Wechsel zwischen Synthese- und Reinigungsmodus.
2. Einschränkungen:
- Es kann bestimmte komplexe Sequenzen nicht synthetisieren;
- Die Reaktionsgeschwindigkeiten unterscheiden sich zwischen verschiedenen Aminosäuren oder Peptidketten, was eine weitere Optimierung erfordert.
- Das Synthesevolumen ist gering und eignet sich nur für Synthesen im Mikrogramm- bis Milligrammbereich.
VIII. Gesamtschlussfolgerung:
Diese Studie stellt eine einfache, sichere und kostengünstige Plattform zur Peptidsynthese vor, die die simultane Reaktion und Detektion mittels eines herkömmlichen HPLC-Systems ermöglicht. Dieser Ansatz erhält nicht nur die stereochemische Integrität des Produkts, sondern erlaubt auch die Synthese komplexer, biologisch aktiver Sequenzfragmente und trägt somit zur breiteren Anwendung von Durchflusssynthesetechniken in mehr Laboren bei.
Über Highfine Biotech:
Suzhou Highfine Biotech Co., Ltd. (Börsenkürzel: 301393.SZ), gegründet 2003 und ansässig in der Suzhou High-Tech-Zone, ist ein nationales Hightech-Unternehmen, das Spezialrohstoffe für die pharmazeutische Forschung und Entwicklung sowie die Produktion weltweit anbietet. Die Produkte werden hauptsächlich in der Peptid-, Nukleotid- und pharmazeutischen Synthese eingesetzt und umfassen ein breites Spektrum, darunter Kondensationsmittel für die spezielle Amidbindungsknüpfung, Schutzmittel, Linker, Proteinvernetzungsmittel für Antikörper-Wirkstoff-Konjugate, molekulare Bausteine, Liposomen und Phosphorreagenzien. Aktuell entwickelt und produziert das Unternehmen über 1500 Produkte.
Nach 22 Jahren kontinuierlicher Entwicklung und Erfahrung hat Highfine Biotech seine Expertise im Bereich globaler Peptidsynthese-Reagenzien stetig ausgebaut und sich zu einem führenden Unternehmen mit einem umfassenden Angebot an kundenspezifischen Produkten und bedeutenden Vorteilen in der Großproduktion entwickelt. So kann Highfine Biotech die spezifischen Bedürfnisse verschiedenster Kunden erfüllen. Wir laden interessierte Kunden herzlich ein, sich für weitere Informationen und zur Besprechung von Kooperationsmöglichkeiten mit uns in Verbindung zu setzen.
Referenzen:
[1] Romanens, P.; Barluenga, MD; Winssinger, N., et al. Peptides on Tap: Automated Flow Synthesis with Standard HPLC [J]. ChemRxiv. 2025.