Als Antwort auf die zuvor genannten Probleme entwickelte das Team von Yao Zhujun an der Universität Nanjing einen immobilisierten molekularen Reaktor (RMMRs), der auf dem Acyltransfermechanismus von Ribosomen basiert.
RMMR-Einführung:
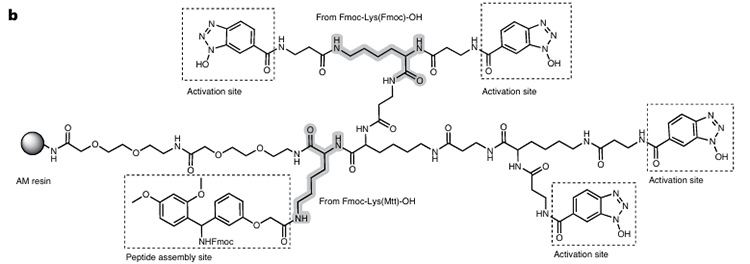
Das RMMR-Harz basiert auf Rink-Amid-Harz und verfügt über dendritisch verteilte Aktivierungsstellen, die durch Fmoc-Lys-Derivate gebildet und schließlich auf AM-Harz fixiert werden (Abbildung 1). Seine Quellfähigkeit ist mit der von kommerziellen Harzen vergleichbar, und es weist eine gute Stabilität ohne Abbau innerhalb von 6 Monaten auf.
Abbildung 1. Zusammensetzung von RMMR
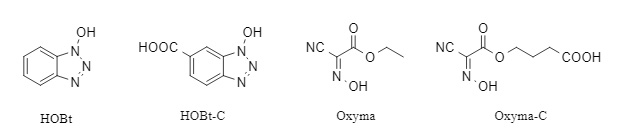
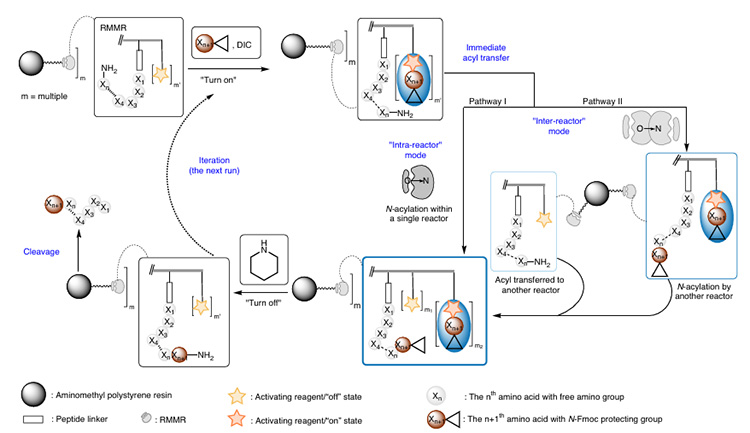
Dieser Reaktor verbindet vier Carboxyl-Aktivierungsstellen (siehe Abbildung 2) und eine Peptidsynthesestelle mit dem Harz. In Gegenwart von DIC und N-Fmoc-Aminosäuren werden mehrere aktive Esterzwischenprodukte gebildet, die einen schnellen intramolekularen oder intermolekularen O→N-Acyltransfer zwischen der N-terminalen Aminogruppe und benachbarten Aktivierungszwischenprodukten ermöglichen (es wird nur eine Oxyacylgruppe gekoppelt). Dadurch wird die Syntheseeffizienz sterisch anspruchsvoller Peptide verbessert. Die abschließende Behandlung mit Piperidin entfernt gleichzeitig die Fmoc-Schutzgruppe und regeneriert nicht umgesetzte aktive Ester. Der Wirkungsmechanismus ist in Abbildung 3 dargestellt.
Abbildung 2. Universelle aktive Aktivatoren und ihre Derivate
Abbildung 3 Wirkungsmechanismus von RMMRs
RMMR-Anwendungen:
1. Konventionelle Peptidsynthese
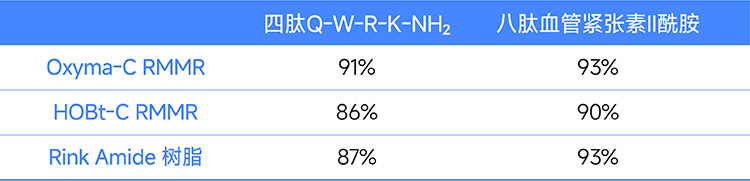
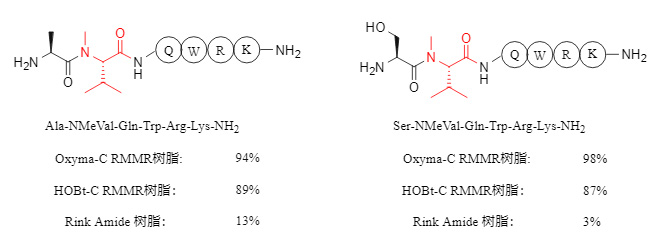
. In der konventionellen Peptidsynthese wurden das Tetrapeptid QWRK-NH₂ und das Oktapeptid Angiotensin-II-Amid unter Verwendung von RMMA-Harz mit Oxyma-C bzw. HOBt-C als aktiven Zentren und kommerziellem Rink-Amid-Harz synthetisiert. Die Ergebnisse sind in der folgenden Tabelle verglichen.
Tabelle 1. Vergleich der Ergebnisse von Tetrapeptiden und Octapeptiden, die mit verschiedenen Harzen synthetisiert wurden
Hinweis: Die Werte in der Tabelle geben die Reinheit des Rohprodukts an.
Experimentelle Ergebnisse zeigen, dass mit RMMR-Harz synthetisierte Peptide eine vergleichbare Qualität aufweisen wie solche, die mit kommerziellem Rink-Amid-Harz synthetisiert wurden. Die Reinheit des Rohprodukts, das mit Oxyma-C RMMR-Harz im manuellen Synthesemodus erhalten wurde, beträgt 97 %, während die Reinheit im automatisierten Synthesemodus 94 % beträgt. Dies belegt die ähnlichen Ergebnisse beider Methoden.
2. Sterisch gehinderte Peptidsynthese
(1) Synthese von N-methylierten Peptiden
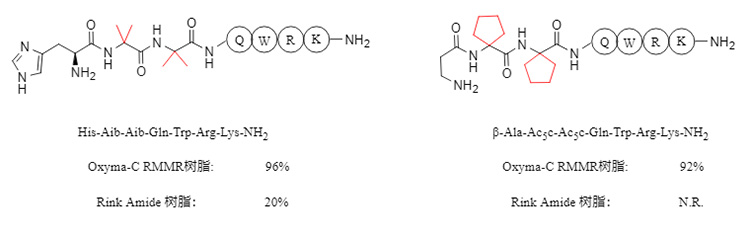
Bei der Synthese von Peptiden mit N-methylierten Aminosäuren verbessert RMMR-Harz die Kondensationseffizienz signifikant. Die Produktreinheit erreicht bis zu 98 %, während die Reinheit der mit Rink-Amid-Harz erhaltenen Produkte meist unter 20 % liegt. Einige Beispiele sind in Abbildung 4 dargestellt.
Abbildung 4. Synthese von N-methylierten Peptiden unter Verwendung verschiedener Harze
(2) Synthese von α,α-disubstituierten Peptiden:
RMMR-Harz zeigt auch bei der Synthese von Peptiden mit α,α-disubstituierten Aminosäuren (wie z. B. Aib, α-Aminoisobuttersäure) eine ausgezeichnete Synthesefähigkeit. Bei Sequenzen mit zwei aufeinanderfolgenden α,α-disubstituierten Aminosäuren (siehe Abbildung 5) kann die Reinheit über 90 % erreichen. Im Gegensatz dazu ist die Synthese entsprechender Peptide mit kommerziell erhältlichem Rink-Amid-Harz schwierig.
Abbildung 5. Synthese von kontinuierlichen α,α-disubstituierten Peptiden unter Verwendung verschiedener Harze
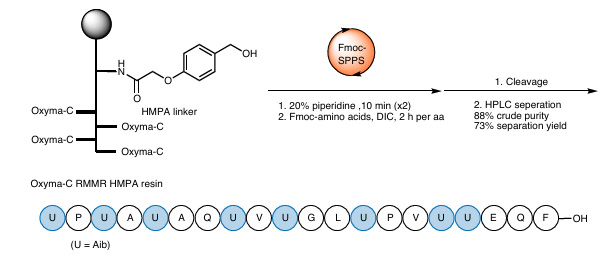
(3) Synthese komplexer molekularer Alamitecin-F-Analoga
Abbildung 6 Synthese von Alamethicin-F-Analoga
Um die Anwendbarkeit von RMMR-Harzen in komplexen Strukturen weiter zu überprüfen, synthetisierte das Team ein Alameticin-F-Analogon mit acht Aib-Resten mithilfe von Oxyma-C RMMR-Harz. Die experimentellen Ergebnisse zeigten, dass RMMR-Harze auch für sterisch anspruchsvolle Peptide gleichermaßen effizient sind: Die Reinheit des erhaltenen Rohprodukts erreichte bis zu 88 %, und die Ausbeute der Trennung lag bei 73 %.
Diese Experimente belegen, dass RMMR-Harze durch ihren immobilisierten Acyltransfermechanismus die Einschränkungen der traditionellen Festphasensynthese bei der Herstellung sterisch anspruchsvoller Peptide überwinden und die Kondensationseffizienz deutlich verbessern.
Gesamtfazit:
Die Harzserie RMMR bietet eine effiziente und zuverlässige Lösung für die Synthese sterisch anspruchsvoller Peptide mit pharmazeutischem Potenzial. Sie ahmt den Acyltransfermechanismus von Ribosomen nach und eignet sich besonders für die Einführung N-methylierter und α,α-disubstituierter Aminosäuren. Darüber hinaus benötigt die Synthese komplexer Aminosäuren mit dieser Harzserie lediglich handelsübliche Fmoc-Aminosäuren und DIC-Reagenzien und ist sowohl mit manuellen als auch mit automatisierten Synthesemethoden kompatibel, was ein breites Anwendungsspektrum eröffnet.
Unternehmensvorstellung:
Nach 22 Jahren kontinuierlicher Anstrengungen und stetiger Weiterentwicklung hat sich Haofan Biotech zu einem führenden Unternehmen im Bereich der globalen Peptidsynthese-Reagenzien entwickelt. Das Unternehmen bietet ein breites Spektrum an kundenspezifischen Produkten und verfügt über bedeutende Vorteile in der Großproduktion, wodurch es die spezifischen Bedürfnisse verschiedenster Kunden erfüllen kann. Wir laden interessierte Kunden herzlich ein, sich mit uns in Verbindung zu setzen, um mehr über die Produktdetails zu erfahren und Kooperationsmöglichkeiten auszuloten.
Referenzen:
[1] Wei, S.; Zhang, X.; Yao, Z., et al. Immobilized acyl-transfer molecular reactors enable the solid-phase synthesis of sterically hindered peptides[J]. Nat. Chem. 2025, 17, 1596−1606.