10/8/2021
Trimethylsilylethoxycarbonyl (Teoc) unterscheidet sich von Cbz, Boc, Fmoc und Alloc. Es ist sehr stabil gegenüber Säuren, den meisten Laugen und Edelmetallkatalyse. In seiner Anwesenheit können Cbz, Boc, Fmoc und Alloc usw. selektiv entschützt werden, und seine Entfernung erfolgt normalerweise im Fluoridanion
Anwendung der Trimethylsilylethoxycarbonyl (Teoc)-Schutzgruppe
Strukturformel:

Der Einführungsmechanismus von Trimethylsilylethoxycarbonyl (Teoc):
Die Einführung der Teoc-Schutzgruppe erfolgt am Beispiel von Teoc-Osu. Der Mechanismus ist wie folgt:

Der Entfernungsmechanismus von Trimethylsilylethoxycarbonyl (Teoc):

Anwendung von Trimethylsilylethoxycarbonyl (Teoc):
In den letzten Jahren hat sich die Verwendung von Reagenzien auf Siliziumbasis zum Schutz aktiver funktioneller Gruppen rasant entwickelt, und Trimethylsilylethoxycarbonyl (Teoc) wird am häufigsten als Schutzmittel für Aminogruppen in der organischen Synthese und Biochemie verwendet. Trimethylsilylethoxycarbonyl (Teoc) unterscheidet sich von Cbz, Boc, Fmoc und Alloc. Es ist sehr stabil gegenüber Säuren, den meisten Basen und Edelmetallkatalyse. In seiner Gegenwart kann es selektiv entschützt werden, und seine Entfernung wird normalerweise in Fluoridanionen wie TBAF, TEAF und HF durchgeführt. Alternativ kann TFA auch selektiv die Trimethylsilylethoxycarbonylgruppe entschützen.
Anwendung 1: Schutz konventioneller Aminogruppen
Die Teoc-Schutzgruppe verwendet üblicherweise Teoc-Cl, Teoc-NT, Teoc-OSu oder Teoc-OBt, um in Gegenwart einer Base mit Aminoverbindungen zu reagieren. Die Base kann organisch sein, Pyridin, Triethylamin oder eine anorganische Base, Natriumbicarbonat, sodass Teoc-geschützte Aminoderivate erhalten werden können.
In der Studie über carbamatgeschützte Aminogruppen erklärte Mamoru, dass die Reaktionsstabilität der Teoc-Schutzgruppe hoch ist; das Schutzreagenz nimmt nicht leicht Feuchtigkeit auf. Es kann sogar der Reaktion ausgesetzt werden, und das mit Teoc-NT hergestellte Nitroimidazol kann auch recycelt werden. Manchmal kann mit hochreinem Teoc-Reagenz Aminoderivate mit höherer Reinheit erhalten werden, ohne dass eine mühsame Reinigung durch Säulenchromatographie erforderlich ist.
Beispiel 1: Teoc-OBt/Triethylamin-System Ausbeute 92%

Beispiel 2: Teoc-Cl/Natriumbicarbonat-System, Ausbeute 87 %

Beispiel 3: Teoc-Osu/Triethylamin-System ergibt 95 %

Beispiel 4: Teoc-NT/Triethylamin-System Ausbeute 98%

Anwendung 2: Aminoschutz von Nukleosidderivaten
Da die Einführung der Teoc-Schutzgruppe relativ sauber und einfach zu handhaben ist, wird sie auch häufig zum Schutz von Nukleotiden verwendet. Beispielsweise können Cytidinderivate Teoc-Gruppen ohne Base einführen, wie in der folgenden Abbildung gezeigt:

Ebenso ist das 6-NH2 des Adenosinderivats 14A sehr erfolgreich bei der selektiven Einführung von Teoc-Gruppen unter neutralen Bedingungen. Dennoch ist die Reaktion der Aminogruppe von Guanosinderivaten ohne Base schwierig durchzuführen, und Triethylamin wird benötigt. Als Base dient Teoc-Cl als Einführungsmittel, wie in der folgenden Abbildung gezeigt:

Obwohl die Teoc-Gruppe in Nukleosid-Derivaten weit verbreitet ist, deuten die Berichte darauf hin, dass die Einführung der Teoc-Gruppe in das 2-NH2 von 2,2'-Desoxyguanosin-Derivaten nicht erfolgreich war.
Anwendung 3: Aminoschutz von Aminosäurederivaten
Aufgrund der Vielfalt der Aminosäurederivate ist auch der Schutz ihrer Aminogruppen wichtiger. Je nach Bedarf werden verschiedene Schutzgruppen ausgewählt, und häufig wird auch die Teoc-Schutzgruppe ausgewählt.
Richard's experimentelle Tabelle zum Teoc-Schutz von Aminosäurederivaten:
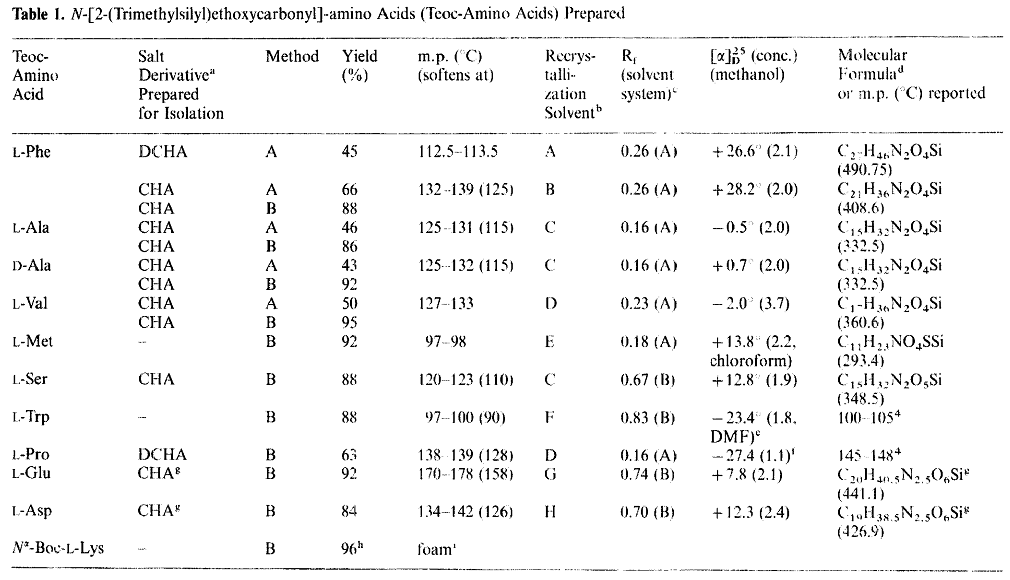
L-Serin verwendet Triethylamin als Base und Teoc-Cl als Einführungsmittel, wie in der folgenden Abbildung gezeigt:
Der Teoc-Schutz von L-Glutaminsäure ist wie folgt:

Aus den obigen Berichten ist ersichtlich, dass die Teoc-Schutzgruppe eine starke Anwendbarkeit beim Aminosäureschutz hat.
Versuchsbetrieb:
Schutz auf Instanz 1:
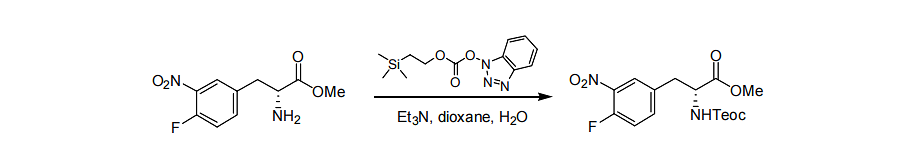
Das Ausgangsmaterial (3,0 g, 12,4 mmol, 1,0) wurde zu Dichlormethan (50 ml) gegeben, gefolgt von Triethylamin (3,25 g, 32,2 mmol, 2,6). Dann Teoc-OBt (3,52 g, 13,63 mmol, 1,1), Temperatur bei 20–25 °C regeln, bis die Ausgangsstoffe vollständig verbraucht sind. 20 ml gesättigte Kaliumhydrogensulfatlösung zur Reaktion geben, die organische Phase abtrennen und mit 20 ml gesättigter Kochsalzlösung waschen, die organische Phase mit wasserfreiem Magnesiumsulfat trocknen, filtern und konzentrieren, um 4,4 g des Produkts mit einer Ausbeute von 92 % zu erhalten.
Beispiel 2: Entschützung:

Der Rohstoff (5,5 g, 18,68 mmol, 1,0) wurde zu Tetrahydrofuran (70) gegeben, und Tetrabutylammoniumfluorid (7,33 g, 28,02 mmol, 1,5) wurde portionsweise zugegeben und bei Raumtemperatur umgesetzt, bis der Rohstoff vollständig verbraucht war. Die Reaktionslösung wurde konzentriert, um Tetrahydrofuran zu entfernen, und das Rohprodukt wurde durch Säulenchromatographie mit einer Ausbeute von 85 % erhalten.
Quellen:
[1]Boger, Dale L; Kim, Seng Heon et al., J. Am. Chem. Soc., 2001, 123(9), 1862-1871;
[2]Shute, Richard; Rich, Daniel H; Synthesis, 1987, 4, 346-349
[3] Mamoru Shimizu; Mikiko Sodeoka., ORGANIC LETTERS., 2007 , Vol. 9, No. 25, 5231-5234
[4] Seng Heon et al., J. Am. Chem. Soc., 2000, 122(30), 7416-7417
[5] Gugiu, Bogdan G; Salomon, Robert G; Org. Lett., 2003, 5(16), 2797-2800
[6]Tius, Marcus A; Thurkauf, Andrew; Tetrahedron Lett., 1986, 27(38), 4541-4544
Hier stellen wir Ihnen unsere beliebten verwandten Produkte vor, die Sie interessieren könnten. Wenn Sie Fragen haben, setzen Sie sich bitte mit uns in Verbindung; unsere Spezialisten werden Ihnen innerhalb von 24 Stunden antworten.
Bitte füllen Sie das untenstehende Formular aus und unser Vertriebsteam wird Ihnen gerne ein Angebot für Peptidsynthesereagenzien unterbreiten.