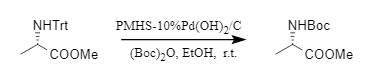Trityl-Schutzgruppen sind sterisch gehindert, bieten milde Ein- und Ausschlussbedingungen, sind einfach zu handhaben und weisen eine hohe Stabilität auf. Daher eignen sie sich besonders für den selektiven Schutz multifunktioneller Verbindungen. Darüber hinaus erleichtert die Einführung von Trityl-Schutzgruppen die Kristallisation und vereinfacht so die Reinigung durch Kristallisation.
1. Einleitung
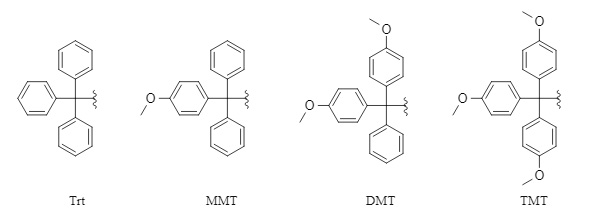
Zu den gängigen Trityl-Schutzgruppen gehören
Trityl (Trt), 4-Methoxytrityl (MMT), 4,4'-Dimethoxytrityl (DMT) und 4,4',4"-Trimethoxytrityl (TMT) (Abbildung 1) . Diese Reihe von Schutzgruppen ist unter alkalischen Bedingungen oder in Gegenwart von Nukleophilen relativ stabil, lässt sich unter sauren Bedingungen jedoch leicht entfernen. Die Entfernungsaktivität unter sauren Bedingungen verläuft in der Reihenfolge TMT > DMT > MMT > Trt. Da die Einführungs- und Entfernungsmethoden dieser Reihe von Schutzgruppen im Allgemeinen ähnlich sind, konzentriert sich dieser Artikel auf Trt als Beispiel.
Abbildung 1: Gängige Schutzgruppenstrukturen der Tritylreihe
2. Einführungsmethode
Aufgrund ihrer erheblichen sterischen Hinderung werden Tritylschutzgruppen häufig zum Schutz primärer Amine verwendet. Ihre Funktionalität ähnelt der von Ethyltrifluoracetat und N-Ethoxycarbonylphthalimid und ermöglicht so den selektiven Schutz primärer Amine. Darüber hinaus kann der Tritylschutz bei der Peptidsynthese die Racemisierung während der Reaktion wirksam hemmen, weshalb er sich besonders für histidinhaltige Peptide eignet.
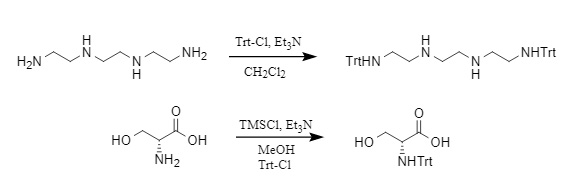
Die Trt-Schutzgruppe wird typischerweise mit Trt-Cl unter alkalischen Bedingungen eingeführt, was eine der gängigsten Methoden ist. Andere Methoden umfassen die Verwendung von Trt-OH (Tritylalkohol) und Ac2O unter sauren Bedingungen oder die Verwendung einer Kombination aus TMSCl/Et3N/Trt-Cl zur Einführung der Tritylgruppe. Beispiele sind in Abbildung 2 dargestellt:
Abbildung 2 Beispiel für die Einführung von Trityl
3. Entfernungsmethode
Obwohl die Tritylgruppe relativ stabil ist, handelt es sich um eine säureempfindliche Gruppe, die unter verschiedenen sauren Bedingungen, wie Salzsäure, TFA und Essigsäure, leicht entfernt werden kann. Die Boc-Schutzgruppe wird typischerweise ebenfalls unter sauren Bedingungen entfernt, was eine selektive Entfernung je nach Säureempfindlichkeit der verschiedenen Schutzgruppen ermöglicht. Beispielsweise kann Trt in einer 50%igen wässrigen HOAc-Lösung leicht entfernt werden, während die Boc-Schutzgruppe unberührt bleibt. Sieber et al. untersuchten die Stabilität der Trt- und Boc-Schutzgruppen in Trt-His(Trt)-Lys(Boc)-OMe (Abbildung 3) und fanden heraus, dass die Trt-Schutzgruppe an der Histidinseitenkette stabiler ist als die Trt-Schutzgruppe an der α-Aminogruppe. Darüber hinaus wird in einem 1 N HCl/Essigsäure-System die Boc-Schutzgruppe entfernt, während die Trt-Schutzgruppe an der Histidinseitenkette unberührt bleibt.
![Studie zur Stabilität von Trt- und Boc-Schutzgruppen in Trt-His(Trt)-Lys(Boc)-OMe Studie zur Stabilität von Trt- und Boc-Schutzgruppen in Trt-His(Trt)-Lys(Boc)-OMe]()
Abbildung 3 Studie zur Stabilität von Trt- und Boc-Schutzgruppen in Trt-His(Trt)-Lys(Boc)-OMe
Darüber hinaus kann die Tritylgruppe mit den folgenden Methoden entschützt werden:
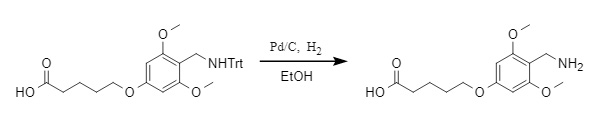
1. Reduktive Entfernung: Die Trt-Schutzgruppe kann unter reduzierenden Bedingungen wie Pd/C-Hydrierung (siehe Abbildung unten) und Na/NH3(l) entfernt werden. Bei der katalytischen Hydrierung ist die Entfernungsrate von Trt deutlich geringer als bei anderen Schutzgruppen wie O-Bn und N-Cbz, was eine selektive Entfernung basierend auf den Eigenschaften verschiedener Schutzgruppen ermöglicht.
Abbildung 4 Pd/C-katalytische Hydrierung zur Trt-Entfernung
Darüber hinaus entwickelte das Chandrasekhar-Team eine Methode, um N-Trt-Schutz in einem Schritt in N-Boc-Schutz umzuwandeln. Durch die Einwirkung von Pd(OH)2/C und PMHS (Polymethylhydrogensiloxan) können N-Boc-Verbindungen in einem einzigen Schritt mit hoher Effizienz und einem breiten Substratspektrum synthetisiert werden.
Abbildung 5 Einstufige Synthese des N-Boc-Schutzes
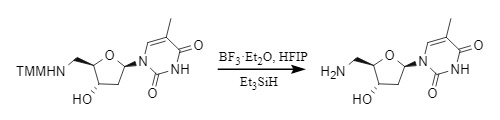
2. Entfernung von Lewis-Säuren: Für protonenempfindliche Substrate sind Lewis-Säuren wie ZnBr2, BF3·Et2O usw. wirksame Entschützungsreagenzien. Beispielsweise ist im System BF3·Et2O/Me3SiH/HFIP (Hexafluorisopropanol) eine schnelle und effiziente Entfernung möglich:
Abbildung 6 Lewis-Säure-Demethylierung von MMT
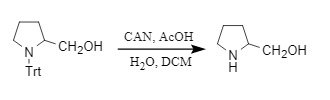
3. Entfernung des CAN-Reagenzes (Cerammoniumnitrat): Das CAN-Reagenz kann Trt durch Einzelelektronentransfer entfernen und so die Aminogruppe in ein Aminoanion umwandeln. Dabei werden Essigsäure und andere Säuren benötigt, um Wasserstoffprotonen bereitzustellen und freie Amine zu erhalten, andernfalls werden die Rohstoffe regeneriert:
Abbildung 7: Trt-Entfernung durch CAN-Reagenz
Trityl-Schutzgruppen werden aufgrund ihrer einfachen Einführung und Entfernung häufig in der Nukleosid- und Peptidsynthese verwendet. Während die sterische Hinderung ihnen eine gute Selektivität verleiht, begrenzt sie auch bestimmte Reaktionen: Bei den meisten Trt-Aminosäuren ist es schwierig, mit gemischten Anhydrid- oder Azidmethoden Amidbindungen aufzubauen, und Trt-Aminosäureester sind aufgrund ihrer erheblichen sterischen Hinderung ebenfalls schwer zu hydrolysieren.
Daher können Forscher, nachdem sie ein tiefes Verständnis der Eigenschaften verschiedener Schutzgruppen erlangt haben, die am besten geeignete Schutzstrategie basierend auf spezifischen Reaktionsbedingungen und Molekülstruktureigenschaften auswählen, um Zielverbindungen effizient zu synthetisieren.
Referenzen:
[1] Zhang Panpan, Zheng Tucai, Chen Sheng, et al. Fortschritte bei der Anwendung von Trityl-Schutzgruppen in der organischen Synthese[J]. Journal of Synthetic Chemistry, 2014, 2, 28-40.
[2] Ito, C.; Taguchi, K.; Matsumoto, K.; et al. Trimethoxytritylgruppen als wirksamer Substituent für Cytidin-Analoga-Prodrugs gegen Krebs[J]. J. Pharm. Sci., 2022, 111, 2201-2209.
[3] Sieber, P.; Riniker, B. Schutz von Carboxamidfunktionen durch den Tritylrest. Anwendung in der Peptidsynthese[J]. Tetrahedron Lett., 1991, 32, 739-742.
[4] Krakowiak, KE; Bradshaw, JS Selektiver Schutz der primären Aminfunktionen linearer Tetraamine durch die Tritylgruppe[J]. Synth. Commun., 1998, 28, 3451-3459.
[5] Baghery, S.; Zarei, M.; Behranvand, V.; et al. Anwendung von Trityleinheiten in chemischen Prozessen: Teil I[J]. J. Iran. Chem. Soc., 2020, 17, 2737-2843.
[6] Sieber, P.; Riniker, B. Schutz von Histidin in der Peptidsynthese: Eine Neubewertung der Tritylgruppe[J]. Tetrahedron Lett., 1987, 28, 6031-6034.
[7] Sharma, SK; Songster, MF; Castellino, FJ; et al. Reduktive Aminierung mit Tritylamin als Ammoniakäquivalent: Effiziente Herstellung des 5-[4-[(9-Fluorenylmethyloxycarbonyl)-amino]methyl]-3,5-dimethoxyphenoxy]valeriansäure (PAL)-Griffs für die Peptidsynthese[J]. J. Org. Chem., 1993, 58, 4993-4996.
[8] Chandrasekhar, S.; Babu, BN; Reddy, CR Einstufige Umwandlung von N-Benzyl-, N-Trityl- und N-Diphenylmethylaminen in t-Butylcarbamate unter Verwendung von Polymethylhydrosiloxan[J]. Tetrahedron Lett., 2003, 44, 2057-2059.
[9] Bege, M.; Bereczki, L.; Herczegh, P.; et al. Ein Dreikomponenten-Reagenzsystem zur schnellen und schonenden Entfernung von O-, N- und S-Trityl-Schutzgruppen[J]. Org. Biomol. Chem., 2016, 1–3.
[10] Pattanayak, S.; Sinha, S. Cerammoniumnitrat-vermittelte Detritylierung von tritylierten Aminen[J]. Tetrahedron Lett., 2011, 55, 34-37.