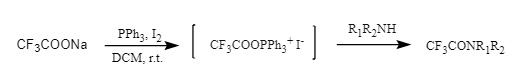1. Einleitung
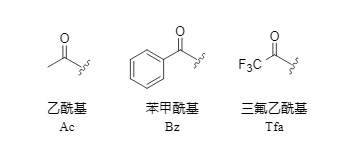
Monoacylgruppen sind eine vielfältige Klasse von Aminoschutzgruppen, die in der Peptid- und Arzneimittelsynthese weit verbreitet sind. Am häufigsten werden Acetyl-, Benzoyl- und Trifluoracetylgruppen verwendet (Abbildung 1). Insbesondere Trifluoracetyl wird in der Peptidsynthese aufgrund seiner einfachen Entfernungsmethode, die sich gut für orthogonale Schutzstrategien eignet, sehr geschätzt.
Abbildung 1 Gängige Monoacyl-Schutzgruppen
Acetyl- und Benzoylgruppen verfügen nicht über starke elektronenziehende Gruppen und erfordern in der Regel strenge Hydrolysebedingungen zur Entfernung, was leicht zur Racemisierung von Polypeptiden und zur Entfernung anderer Schutzgruppen führen kann. Daher unterliegt ihr Anwendungsbereich gewissen Einschränkungen.
2. Nichthalogenierte Acylgruppen
Aufgrund der starken Elektronenaufnahme von Trifluoracetyl unterscheidet es sich deutlich von Benzoyl und Acetyl. Daher werden Benzoyl und Acetyl in diesem Artikel als nichthalogenierte Acylgruppen klassifiziert und einheitlich beschrieben.
1. Einführungsmethode
(1) Konventionelle Methode:
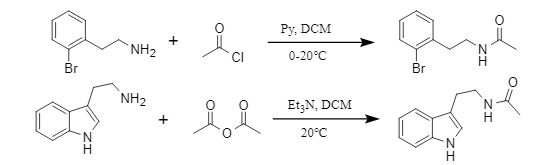
Konventionelle Acyl-Einführungsmethoden verwenden üblicherweise Säureanhydrid/Acylchlorid, um Acylgruppen durch Acylierung in Gegenwart einer Base einzuführen, oder führen Acylgruppen durch Kupplungsreaktion von Carbonsäure und Amin unter der Wirkung eines Kondensationsreagenzes ein. Am Beispiel von Acetyl (Abbildung 2) sind die Einführungsmethoden für Acetylchlorid und Essigsäureanhydrid wie folgt:
Abbildung 2 Methode zur Einführung von Acetylgruppen
(2) Spezielle Methoden:
① Amidmethode
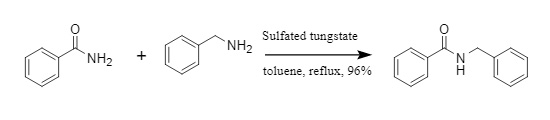
Pathare et al. entwickelten eine durch modifiziertes Wolframat katalysierte Transamidierungsreaktion. Durch die Katalyse von modifiziertem Wolframat werden Amide und Aminverbindungen zu neuen Amidverbindungen umgesetzt (Abbildung 3). Diese Methode ist auf eine Vielzahl aromatischer und aliphatischer Amide anwendbar und zeichnet sich durch milde Reaktionsbedingungen und hohe Effizienz aus.
Abbildung 3 Transamidierungsreaktion katalysiert durch modifiziertes Wolframat
②N-Acylbenzotriazol-Methode
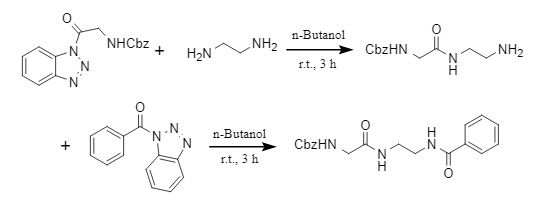
Agha et al. entwickelten eine neue Methode zur Acyl-Einführung. Mit Acylbenzotriazol als Acylierungsmittel können sie ungeschützte aromatische/aliphatische Diamine in grünen Lösungsmitteln wie Wasser und n-Butanol selektiv monoacylieren. Gleichzeitig können sie aliphatische Diamine schrittweise acylieren, um asymmetrische Diamide zu synthetisieren (Abbildung 4).
Abbildung 4 Synthese von asymmetrischem Diamid
2. Deacylierungsmethode:
Die Stabilität der Amidbindung ist relativ hoch, und eine Deacylierung unter milden Bedingungen ist schwieriger. Im Vergleich zur Hydrolyse der Estergruppe erfordert die Hydrolyse der Amidgruppe oft intensivere Bedingungen.
(1) Konventionelle Methode:
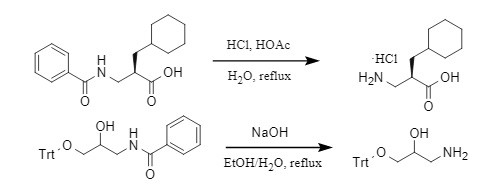
Die Acylgruppe kann im Allgemeinen nur durch eine Hochtemperaturreaktion unter stark sauren/alkalischen Bedingungen entfernt werden. Am Beispiel von Benzoyl (Abbildung 5) wird die Deacylierung unter sauren bzw. alkalischen Bedingungen durchgeführt:
Abbildung 5 Methode zum Entfernen der Benzoylgruppe
(2) Spezielle Methoden:
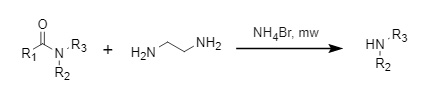
① Ammoniumbromid-Methode
Shimizu et al. entwickelten eine mikrowellenunterstützte Deacylierungsmethode unter Ausnutzung der synergistischen Wirkung von Ammoniumbromid und Ethylendiamin, die eine hohe Ausbeute aufweist und mit einer Vielzahl von funktionellen Gruppen kompatibel ist (Abbildung 6).
Abbildung 6 Synergistische Deacylierung von Ammoniumbromid und Ethylendiamin
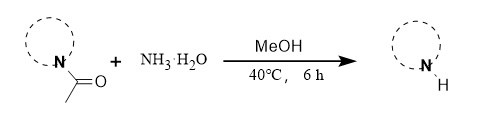
② Ammoniakmethode:
Das Team von Professor Zeng entwickelte eine milde Deacylierungsmethode mit Ammoniak als Deacylierungsreagenz. Die Reaktionsbedingungen sind mild und die Ausbeute hoch. Die Methode ist auf eine Reihe von Verbindungen wie verschiedene substituierte Indole anwendbar (Abbildung 7).
Abbildung 7 Ammoniak-Deacylierungsreaktion
3. Haloacyl
Haloacetylgruppen lassen sich unter dem Einfluss von Halogenatomen leichter entfernen. Eine repräsentative Schutzgruppe ist Trifluoracetyl, die unter milden alkalischen Bedingungen entfernt werden kann und in der Peptid- und Arzneimittelsynthese weit verbreitet ist.
1. Einführungsmethode
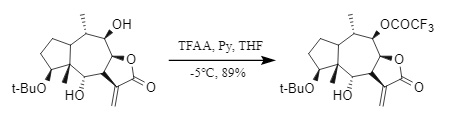
(1) Trifluoressigsäureanhydrid (TFAA): Trifluoressigsäureanhydrid ist hochaktiv und erfordert in der Regel eine niedrige Temperatur und die Anwesenheit einer Base (Abbildung 8). Es ist ein gängiges Trifluoracetylierungsreagenz, kann jedoch bei der Einführung in Tfa leicht Nebenreaktionen wie die Racemisierung des chiralen Zentrums oder die Spaltung der Peptidbindung verursachen.
Abbildung 8: Einführung von Trifluoressigsäureanhydrid in Tfa
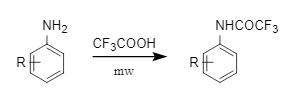
(2) Trifluoressigsäure (TFA): Im Vergleich zu Trifluoressigsäureanhydrid und Trifluoracetylchlorid hat Trifluoressigsäure einen höheren Siedepunkt und ein breiteres Anwendungsspektrum. Sie kann zur mikrowellenunterstützten Trifluoracetylierung substituierter Aniline verwendet werden (Abbildung 9). Sie kann auch durch eine klassische Carbonsäure-Amin-Kondensationsreaktion oder durch direkte Trifluoracetylierung aromatischer Amine durch Erhitzen in Xylol eingeführt werden.
Abbildung 9: Einführung von Trifluoressigsäure in Tfa
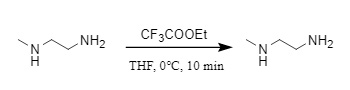
(3) Ethyltrifluoracetat: Ethyltrifluoracetat wird häufig in der Peptidsynthese verwendet und kann durch Reaktion mit Aminen bei 0 °C in THF hergestellt werden. Unter dem Einfluss sterischer Hinderung kann dieses Reagenz primäre Amine in Gegenwart sekundärer Amine selektiv schützen (Abbildung 10). Selbst bei gleichem primären Amin haben unterschiedliche Alkylgruppen unterschiedliche Reaktionseffekte. Beispielsweise reagiert es in Gegenwart von tert-Butylamin und Isobutylamin bevorzugt mit Isobutylamin, das eine geringere sterische Hinderung aufweist (98 %).
Abbildung 10 Einführung von Tfa in Ethyltrifluoracetat
(4) Acyloxyphosphoniumsalze: Iod/Bromid-Acyloxyphosphoniumsalze wurden aus Natriumtrifluoracetat/Triphenylphosphin/Iod oder Trifluoressigsäure/Triphenylphosphin/NBS hergestellt und dann mit Aminen angegriffen, um Trifluoracetamide zu erhalten (Abbildung 11).
Abbildung 11 Einführung von Acyloxyphosphoniumsalz in Tfa
(5) Weitere Reagenzien:
Viele der vorgestellten Reagenzien sind Derivate der Trifluoressigsäure/des Trifluoressigsäureanhydrids. Durch die Synthese von Derivaten mit leicht abspaltbaren Gruppen wie Acylimidazol, Acylbenzotriazol usw. reagieren diese mit Aminen zu den entsprechenden Amiden.
2. Abspaltungsverfahren:
Das Abspaltungsverfahren für Trifluoracetyl ist relativ mild und unter stark sauren Bedingungen relativ stabil. Es ist kompatibel mit Schutzgruppen wie Boc, Z, Trt und Alloc. Die folgenden Abspaltungsverfahren werden üblicherweise verwendet:
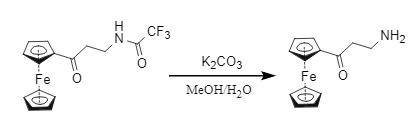
(1) Na2CO3 (K2CO3)/MeOH/H2O (Abbildung 12)
Abbildung 12 Carbonatentfernung von Tfa
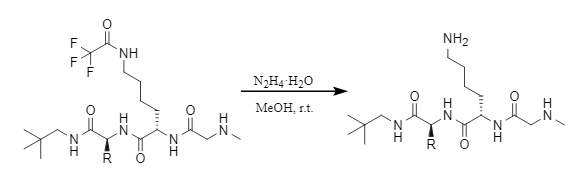
(2) Hydrazinhydrat/Methanol
Abbildung 13 Entfernung von Tfa durch Hydrazinhydrat
(3) Andere Methoden:
Zusätzlich zu den oben genannten Deacylierungsmethoden gibt es mehrere milde Entfernungsmethoden, darunter wässrige NaOH-Lösung, wässrige 1 M Piperidinlösung, NaBH4/EtOH und andere Methoden.
Referenzen:
[1] Guo Yanhao, Hao Qinghui, Hao Siyuan, et al. Schutz und Entschützung von Aminogruppen in chemischen Produkten [J]. Coal and Chemical Industry, 2022, 45, 106-112.
[2] Gao Xuhong, Li Bingqi. Aminoschutz und Anwendung in der organischen Synthese (Übersicht) [J]. Journal of Shihezi University (Natural Science Edition), 1999, 3, 76-86.
[3] Balieu, S.; Toutah, K.; Rousselière, H.; et al. Radikalische Cyclisierung von Inamiden zu Sechs- oder Achtringen. Anwendung auf die Synthese eines Protoberberin-Analogons [J]. Tetrahedron Lett., 2011, 52, 2876-2880.
[4] Warren, HT; Saeger, HN; Rasmussen, K.; et al. Psychoplastogene DYRK1A-Inhibitoren mit therapeutischer Wirkung relevant für die Alzheimer-Krankheit[J]. J. Med. Chem., 2024, 67, 6922−6937.
[5] Pathare, AP; Jain, AKH; Akamanchi, KG Sulfatiertes Wolframat: ein hocheffizienter Katalysator für die Transamidierung von Carboxamiden mit Aminen[J]. RSC Adv., 2013, 3, 7697-7703.
[6] Agha, KA; Abo-Dya, ND, Abdel-Samii, ZK; et al. N Acylbenzotriazol: praktischer Ansatz für die schutzgruppenfreie Monoacylierung symmetrischer Diamine[J]. Monatsh. Chem., 2020, 151, 589–598.
[7] Doboszewski, B., Groaz, E., Herdewijn, P. Synthese von Phosphonoglycin-Rückgrateinheiten für die Entwicklung von Phosphonopeptid-Nukleinsäuren[J]. Eur. J. Org. Chem., 2013, 4804–4815.
[8] Benkel, T.; Annala, S.; Gütschow, M.; et al. BIM-46174-Fragmente als potenzielle Liganden von G-Proteinen[J]. Med. Chem. Commun., 2019, 00, 1-3.
[9] Shimizu, Y.; Morimoto, H.; Zhang, M.; Ohshina, T. Mikrowellenunterstützte Deacylierung nicht aktivierter Amide mittels Ammoniumsalz-beschleunigter Transamidierung[J]. Angew. Chem. Int. Ed. 2012, 51, 8564–8567.
[10] Han Qun, Xu Kun, Zeng Chengchu et al. Eine praktische Methode zur Entfernung von Acylschutzgruppen durch eine Amidotransferreaktion[J]. Organic Chemistry, 2022, 42, 1123-1128.
[11] López, SE; Restrepo, J.; Salazar, J. Trifluoracetylierung in der organischen Synthese: Reagenzien, Entwicklungen und Anwendungen bei der Konstruktion trifluormethylierter Verbindungen[J]. Curr. Org. Synth., 2010, 7, 414-432.
[12] Piotrowicz, M.; Maslowska, N.; Rudolf, B.; et al. Synthese von Trifluoracetamidoketonen durch Acylierung von Ferrocen mit in situ geschützten Aminosäuren[J]. J. Org. Chem., 2025, 90, 2958−2968.
[13] Heller, P.; Weber, B.; Birke, A.; Barz, M. Synthese und sequenzielle Entschützung von Triblock-Copolypept(o)iden mittels orthogonaler Schutzgruppenchemie[J]. Macromol. Rapid Commun., 2015, 36, 38−44.
[14] Isidro-Llobet, A.; Álvarez, M.; Albericio, F. Aminosäure-Schutzgruppen[J]. Chem. Rev., 2009, 109, 2455–2504.