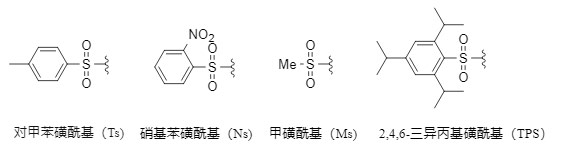
Es ist zu beachten, dass verschiedene Schutzgruppen unterschiedliche Toleranzbedingungen haben. Unter allen Aminoschutzgruppen ist die Sulfonylgruppe (Abbildung 1 zeigt mehrere gängige Sulfonylschutzgruppen) eine der stabilsten Schutzgruppen. Ihre Einführung erfolgt üblicherweise durch die Reaktion von Amin mit dem entsprechenden Sulfonylchlorid in einem inerten Lösungsmittel unter alkalischen Bedingungen. Sie bietet folgende Vorteile:
(1) Es ist mit einer Vielzahl von Reaktionsbedingungen kompatibel und wird durch die Behandlung mit starken Basen, Hydrierung und anderen Bedingungen nicht beeinträchtigt. Darüber hinaus kann das Produkt nach der Einführung der Sulfonylgruppe leicht Kristalle bilden, was die Gewinnung und Reinigung erleichtert.
(2) Durch die Einführung der Sulfonylgruppe wird die NH-Bindung aktiver, so dass die N-Alkylierungsreaktion und die Übergangsmetall-katalysierte CN-Bildung leichter erfolgen können.
Abbildung 1. Gängige Sulfonyl-Schutzgruppen
Die höhere Stabilität der Sulfonylgruppe führt auch zu strengeren Bedingungen für deren Entschützung. Die saure Hydrolyse muss üblicherweise unter strengen Bedingungen, wie z. B. Erhitzen mit konzentrierter Schwefelsäure, durchgeführt werden; eine schonendere Methode ist die reduktive Spaltung, beispielsweise mit Na/NH3(l), Mg/MeOH und anderen Systemen. Diese Methode ist jedoch auf Substrate mit leicht reduzierbaren Gruppen wie Aldehyden, Ketoncarbonylen und Nitrogruppen beschränkt und neigt zu Nebenreaktionen.
Dieser Artikel stellt eine Methode auf Basis stöchiometrischer Trifluormethansulfonsäure zur effektiven Entschützung aromatischer Aminsulfonylgruppen und verwandte Anwendungen vor.
(1) Ausgezeichnete Substratuniversalität:
Bei Raumtemperatur oder unter Erhitzung kann Trifluormethansulfonsäure die Schutzgruppen von unsubstituierten und N-substituierten aromatischen/heteroaromatischen Sulfonamidsubstraten effektiv entfernen und so die entsprechenden aromatischen Amine in hohen Ausbeuten erhalten. Obwohl die Reaktion unter sauren Bedingungen durchgeführt wird, verträgt sie Substrate mit Cyano-, Imid- und Estergruppen sowie basische Substrate wie Pyridin und Chinolin. Diese Methode ist auf Schutzgruppen wie p-Toluolsulfonyl (Ts), Nitrobenzolsulfonyl (Ns), Methylsulfonyl (Ms) und Triisopropylsulfonyl (TPS) anwendbar (Abbildung 2).
Abbildung 2 Trifluormethansulfonsäure-vermittelte Sulfonamid-Entschützungsreaktion
① Neutrale und elektronenarme Substrate: Die NS-Bindung im Sulfonamid wird leicht aufgebrochen, wodurch eine effiziente Entfernung der Sulfonylgruppe erreicht wird (Abbildung 3).
Abbildung 3 Entschützungsreaktion von elektronenarmen Substraten
② Elektronenreiche Substrate: Es kommt zur Fries-Umlagerung (intramolekulare Sulfonylwanderung), bei der eine Reihe von Sulfonverbindungen entsteht (Abbildung 4).
Abbildung 4 Entschützungsreaktion von elektronenreichen Substraten
(2) Selektive Entfernung der Ts-Schutzgruppe:
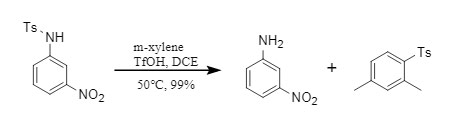
Normalerweise ist es schwierig, die Ts-Schutzgruppe zu entfernen. Das Orentas-Team fand jedoch im Experiment heraus, dass Ts in Gegenwart von TfOH selektiv entfernt werden kann, ohne andere Sulfonyl-Schutzgruppen zu beeinträchtigen (Abbildung 5).
① Ts-Schutzgruppen auf aromatischen Aminen werden bevorzugt entfernt: Es gibt Unterschiede in der Stabilität von Ts-Schutzgruppen an verschiedenen Positionen, darunter lassen sich die Ts-Schutzgruppen auf aromatischen Aminen leichter entfernen;
② Hervorragende Selektivität: Wenn Ts zusammen mit anderen Sulfonyl-Schutzgruppen wie Ns und Ms vorliegt, kann die Ts-Schutzgruppe immer noch selektiv entfernt werden. Sogar wenn das sehr instabile Pyridin-2-sulfonyl zusammen mit Ts vorliegt, wird die Ts-Schutzgruppe immer noch bevorzugt entfernt.
Abbildung 5. Selektive Entfernung der Ts-Schutzgruppe
(3) Andere Anwendungen:
① Intermolekularer Sulfonyltransfer: In Gegenwart elektronenreicher aromatischer Verbindungen können elektronenarme Sulfonamidsubstrate eine FC-Sulfonylierung (bezieht sich hier auf intermolekularen Sulfonyltransfer) durchlaufen, während sie entschützt werden, um Sulfonverbindungen zu erzeugen (Abbildung 6).
Abbildung 6. Intermolekulare Migration von Sulfonylgruppen
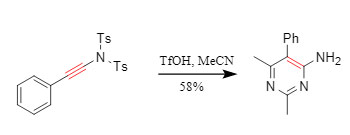
② Eintopf-Cyclisierung: Konjugierte Sulfonamidsubstrate können unter Entschützung eine [2+2+2]-Cycloaddition eingehen. Beispielsweise werden Acetonitril und Acetonitril in Gegenwart von TfOH einer Nitril-Cycloaddition unterzogen, um Aminopyrimidine in einem Eintopfverfahren zu erhalten (Abbildung 7).
Abbildung 7. Cyclisierungsreaktion mit Sulfonamid
Dieser Artikel stellt neue Methoden zur Entfernung von Sulfonylgruppen und ihre erweiterten Anwendungsmöglichkeiten vor und soll Forschern Hilfe und Ideen bieten.
Referenzen:
[1] Orentas, E.; Javorskis, T. Chemoselektive Entschützung von Sulfonamiden unter sauren Bedingungen: Umfang, Migration von Sulfonylgruppen und synthetische Anwendungen [J]. J. Org. Chem., 2017, 82, 13423–13439.
[2] Kisla, MM; Kul, P.; Kus, C.; et al. Einbau von Schutzgruppen in die organische Chemie: Ein Mini-Review [J]. Curr. Org. Synth., 2023, 20, 491–503.
[3] Guo Yanhao, Hao Qinghui, Hao Siyuan et al. Schutz und Entschützung von Aminogruppen in chemischen Produkten [J]. Kohle- und Chemieindustrie, 2022, 45, 106-112.